令和に入ってから出題頻度が高め
製造販売業者等(いわゆる製薬メーカー)には、製造販売、承認を受けた医薬品について、その副作用等によるものと疑われる健康被害や、その使用によるものと疑われる感染症の発生等を知ったときは、定められた期限までに厚生労働大臣に報告することが義務づけられています。(実質的にはPMDAに報告することになる)
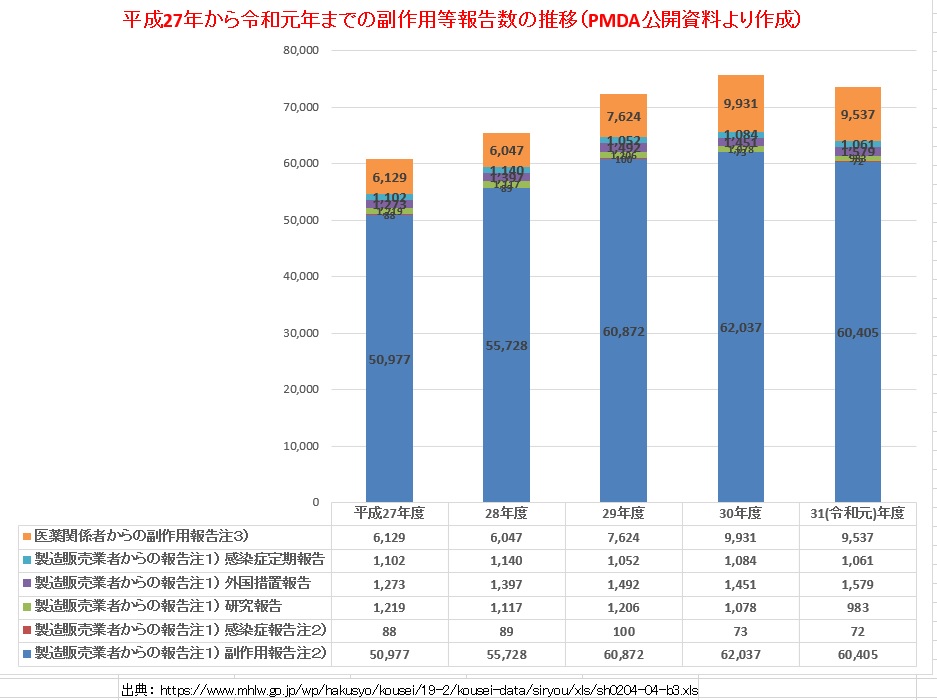
管理人も、実際に行ったことがありますが、医薬関係者による副作用等の報告(医薬品・医療機器等安全性情報報告制度)に比べると、圧倒的に報告数が多く、コロナ前の2019年のデータでは、企業報告は約6万件となっていました。
なお、新型コロナウイルスワクチン接種が開始されてから、明らかにどちらも報告件数が増えており、特に医薬関係者(医療機関)からの報告の増加の方が顕著となっています。
| 年度 | 企業報告 | 医療機関報告 |
| 2018 | 62,110 | 9,931 |
| 2019 | 60,477 | 9,537 |
| 2020 | 51,429 | 10,985 |
| 2021 | 82,308 | 40,374 |
データ出典:https://www.mhlw.go.jp/content/11121000/001094895.pdf
登録販売者試験では、令和に入ったあたりから出題頻度が増加しています。
一番の出題のポイントは、手引き別紙5-4にある、副作用や感染症の重篤度や予測性毎に定められた、報告の期限の有無及び報告期限(15日or30日 or 定期報告)になります。
但し、特に直前期の受験生には、これを闇雲に全て憶えることは無理がありますので、まずは以下の点を憶えると良いでしょう。
①重篤性と予測性等から、報告期限は「15日以内」と「30日以内」、さらに「定期報告」がある。
②とりあえず「死亡した事例」「感染症症例」は「15日以内」で憶える
③使用上の注意から予測できず、非重篤⇒「定期報告」(使用上の注意から予測でき、非重篤⇒「報告義務なし」)
④研究報告は「30日以内」
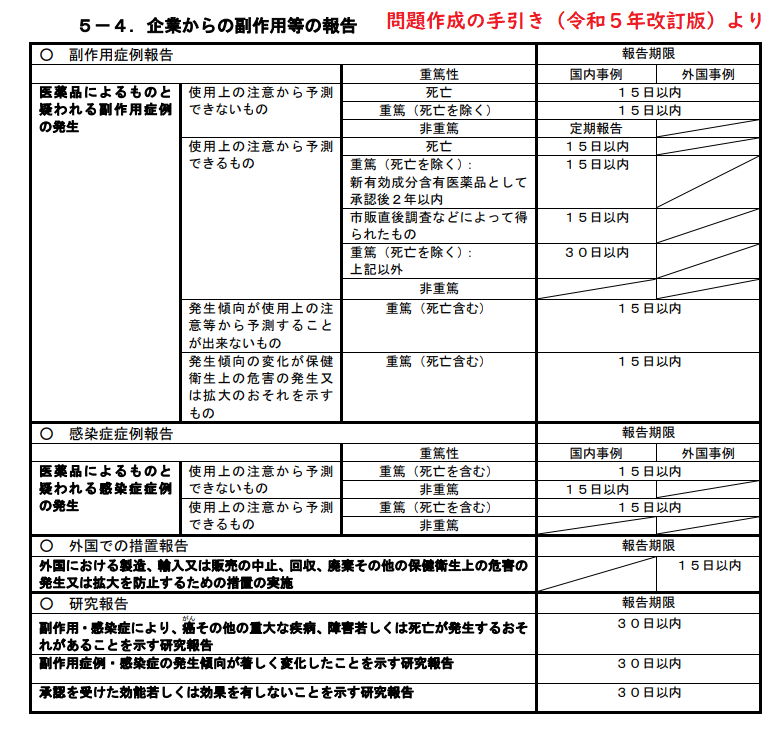
なお、細かい部分が問われることがあり、令和5年奈良県の試験では、市販直後調査で得られた副作用情報(15日以内)も出題されたケース等もあります。
他のポイントも確認しておきます。
「製造販売業者等には、法第68条の10第1項の規定に基づき、その製造販売をし、又は承認を受けた医薬品について、その副作用等によるものと疑われる健康被害の発生、その使用によるものと疑われる感染症の発生等を知ったときは、その旨を定められた期限までに厚生労働大臣に報告することが義務づけられている。なお、実務上は(中略)報告書を総合機構に提出することとされている。」
⇒医療機関自身が報告を行う医薬品等安全性情報報告制度とは異なり、報告の期限があることがポイントです。
「薬局開設者、医療施設の開設者、医薬品の販売業者又は医師、歯科医師、薬剤師その他の医薬関係者(登録販売者を含む。)においては、法第68条の2の5第2項により、製造販売業者等が行う情報収集に協力するよう努めなければならないこととされている」
⇒登録販売者も、情報収集に協力する必要があります。
(参考)
平成27年から令和元年度までの副作用報告の統計データです。
出典:https://www.mhlw.go.jp/wp/hakusyo/kousei/19-2/kousei-data/siryou/xls/sh0204-04-b3.xls