医療関係者からの報告による副作用情報の収集
医薬品・医療機器等安全性情報報告制度とは、日常の医療・販売の現場で、医薬品・医療機器等を使用したことによって生じた健康被害などの情報を、法に基づいて、医薬関係者(医師、薬剤師や登録販売者なども含む)が厚生労働大臣(実務上はPMDA)に報告する制度です。
↓医薬品・医療機器等安全性情報報告制度パンフレットより


しかし、医薬関係者の間でも、あまり広く馴染みのある制度ではありません。(著者の知る範囲では、実際にこの報告を行った登録販売者に関する情報は残念ながら聞いたことはありません。)
登録販売者試験では、通常1題以上は出題されています。
出題の手引き(R6改訂版)の出題されそうなポイントは以下のとおり
「(医薬品・医療機器等安全性情報報告制度は)薬局開設者、病院、診療所・・・医師、歯科医師、薬剤師、登録販売者、獣医師その他の医薬関係者は、医薬品の副作用等によるものと疑われる健康被害の発生を知った場合において、保健衛生上の危害の発生又は拡大を防止するため必要があると認めるときは、その旨を厚生労働大臣に報告しなければならないとされている。」
「なお、実務上は・・・の規定により、報告書を総合機構に提出することとされている。」
→実際の報告先は、パンフレットからもわかる通り医薬品医療機器総合機構(PMDA)ですが、試験対策では「厚生労働大臣」も憶えて下さい。
「・・・1997年7月に「医薬品等安全性情報報告制度」として拡充し、2002年7月には薬事法が改正され、医師や薬剤師等の医薬関係者による副作用等の報告を義務化することにより、副作用等に関する情報の収集体制がより一層強化された。」
「2006年6月の薬事法改正よる登録販売者制度の導入に伴い、登録販売者も本制度に基づく報告を行う医薬関係者として位置づけられている。」
→「義務」であることがポイントです。
次に、「医薬品による副作用等が疑われる場合の報告の仕方」についての出題ポイントです。
「医薬品等によるものと疑われる、身体の変調・不調、日常生活に支障を来す程度の健康被害(死亡を含む。)について報告が求められている。」
「医薬品との因果関係が必ずしも明確でない場合であっても報告の対象となり得る。」
「安全対策上必要があると認めるときは、医薬品の過量使用や誤用等によるものと思われる健康被害についても報告がなされる必要がある」
「報告様式は、医薬品・医療機器等安全性情報と同様、総合機構の「医薬品医療機器情報提供ホームページ」から入手できる」
→ホームページから簡単に入手することができます。
(実際に入手した報告書)
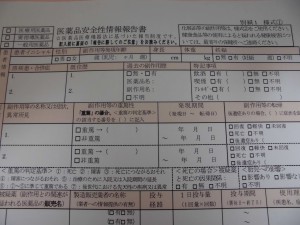
「報告様式の記入欄すべてに記入がなされる必要はなく、医薬品の販売等に従事する専門家においては、購入者等(健康被害を生じた本人に限らない)から把握可能な範囲で報告がなされればよい。」
→全て記入する必要はありません。
「複数の専門家が医薬品の販売等に携わっている場合であっても、当該薬局又は医薬品の販売業において販売等された医薬品の副作用等によると疑われる健康被害の情報に直接接した専門家1名から報告書が提出されれば十分である。」
→専門家が複数人関わっていても、報告は情報に直接接した専門家1名からの報告でOKです。
「報告期限は特に定められていないが、保健衛生上の危害の発生又は拡大防止の観点から、報告の必要性を認めた場合においては、適宜速やかに、郵送、ファクシミリ又は電子メールにより、報告書を総合機構に送付することとされている。」
→意外かもしれませんが、報告期限は定められていません。製造販売業者は、定められた期限までに報告する義務があるので混同しないように。
「報告者に対しては、安全性情報受領確認書が交付される。」
→これが結構出題されています。
「なお、本報告は、令和3年4月から、ウェブサイトに直接入力することによる電子的な報告が可能となった。」
→R4手引きの改訂で追加となった部分です。
「医薬部外品又は化粧品による健康被害についても、自発的な情報協力が要請されている。」
「なお、無承認無許可医薬品又は健康食品によると疑われる健康被害については、最寄りの保健所に連絡することとなっている。」
→医薬部外品、化粧品も対象になっていることには注意。無承認無許可医薬品又は健康食品の場合は保健所に連絡することも余裕があれば憶えて。
以上、「医薬品・医療機器等安全性情報報告制度」に関する出題についてまとめました。特に報告の仕方に関してはよく出題されているので、頻出ポイントは押さえておきましょう。
繰り返しになりますが、必ず出題される分野なので、ぜひPMDAのホームページから関連情報を一度確認しておきましょう。


