とりあえず販売数年以内のスイッチOTC医薬品、ダイレクトOTC医薬品をイメージすれば良い
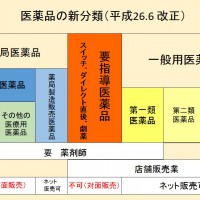
要指導医薬品とは、平成26年6月の薬事法改訂により、新しく登場した医薬品の分類名です。
とりあえず、具体例としては、医療用医薬品から転用されたスイッチOTC医薬品とイメージするのが一番わかりやすいですが、他にもダイレクトOTC医薬品や、劇薬に該当するもの等もあり、覚えるポイントは複数あります。
また、要指導医薬品としての分類は、販売年数を経ることで他の区分(第一類)に変更されることも多いことも押さえておきましょう。
↓2021年11月に販売された要指導医薬品 バップフォー(女性用 過活動膀胱治療薬)

その定義については、薬機法において以下のように定義されています。
「(中略)その効能及び効果において人体に対する作用が著しくないものであつて、薬剤師その他の医薬関係者から提供された情報に基づく需要者の選択により使用されることが目的とされるものであり、かつ、その適正な使用のために薬剤師の対面による情報の提供及び薬学的知見に基づく指導が行われることが必要なものとして、厚生労働大臣が薬事審議会の意見を聴いて指定するものをいう。」
⇒赤字の部分は、良く問われるところなので是非憶えておきたいところです。
⇒薬剤師の「対面」による情報提供・指導が必須なっている点は重要です。このため、要指導医薬品は特定販売(≒ネット販売)ができません。
「医療用医薬品において使用されていた有効成分が初めて配合されたものや既存の医薬品と明らかに異なる有効成分が配合されたもののうち、その適正な使用のために薬剤師の対面による情報の提供及び薬学的知見に基づく指導が行われることが必要なものについては、薬事審議会の意見を聴いた上で、厚生労働大臣が要指導医薬品として指定する。」
⇒「医療用医薬品において使用されていた有効成分が初めて配合されたもの」は、いわゆるスイッチOTC医薬品のことで、医療現場で使用されていた有効成分を市販薬において初めて転用したものです。
令和に入ってからの具体例としては、2020年9月に販売された「ヒアレイン🄬S点眼液」(精製ヒアルロン酸ナトリウム点眼液)や、2020年12月に販売された「タリオンⓇAR」(ベポタスチンベシル酸塩)等があります。
また、令和3年以降は、既存の市販成分(第1類、第2類)を組み合わせた新製品も要指導医薬品として登場しており、例えばアレグラ🄬FXプレミアム(フェキソフェナジンとプソイドエフェドリン塩酸塩の合剤)や、ルルアタックLX(ロキソプロフェンナトリウムを配合した総合感冒薬)等が発売されています。
⇒一方で「既存の医薬品と明らかに異なる有効成分が配合されたもの」は、いわゆるダイレクトOTC医薬品のことで、(日本において)医療用医薬品での使用を経ずに、市販薬として登場した成分が配合された医薬品です。
具体例は限られますが、最も新しい例では、2024年4月8日に発売された日本発の内臓脂肪減少薬「アライ」が該当します。(海外では医療用医薬品を経てOTC化された国が多いですが、日本国内では医療用医薬品での発売を経ずに市販された為、ダイレOTC医薬品の扱いになっています)
また、1999年6月に販売が開始された壮年性脱毛症の発毛剤リアップ🄬(ミノキシジル)も、ダイレクトOTC医薬品です。
他にも、市販薬において劇薬に該当する医薬品も、要指導医薬品として販売されており、例えば、勃起障害等改善薬のヨヒンビン塩酸塩(ガラナポーン)があります。なお、厚生労働省の要指導医薬品の一覧(2025.1.8確認)で4種類の医薬品が掲載されていますが、ガラナポーン以外については、販売が継続されているかは不明です。
参考:要指導医薬品一覧(厚生労働省リンク)
次に、要指導医薬品に関連して第5章で出題される、ダイレクトOTC医薬品の再審査制度と、スイッチOTC医薬品の安全性等に関する製造販売後調査についても確認しておきます。
「一般用医薬品に関しても、承認後の調査が製造販売業者等に求められており、副作用等の発現状況等の収集・評価を通じて、承認後の安全対策につなげている。具体的には既存の医薬品と明らかに異なる有効成分が配合されたものについては、10年を超えない範囲で厚生労働大臣が承認時に定める一定期間(概ね8年)、承認後の使用成績等を製造販売業者等が集積し、厚生労働省へ提出する制度(再審査制度)が適用される。」
⇒ダイレクトOTC医薬品に関する記述になりますが、例えば、内臓脂肪減少薬「アライ」についても、再審査期間は8年間となっており、その使用成績・評価によっては区分が変更される場合があります。
「また、医療用医薬品で使用されていた有効成分を一般用医薬品で初めて配合したものについては、承認条件として承認後の一定期間(概ね3年)、安全性に関する調査及び調査結果の報告が求められている。要指導医薬品は、上記と同様に調査結果の報告が求められている。」
⇒一方で、こちらはスイッチOTC医薬品に関する記述になりますが、殆どのスイッチOTC医薬品では調査期間は3年となっており、特に大きな問題が無ければ、第一類医薬品に区分変更されることが多いです。